Etude quantitative de la paroi vasculaire
Étude quantitative de la paroi vasculaire
Les techniques ultrasonographiques permettent l’étude quantitative non vulnérante de la paroi artérielle en termes morphologiques, biomécaniques, et fonctionnels, apportant ainsi des données complémentaires de grande valeur clinique et pronostique(16,17,18,19,20,21,22).
1 – Morphologie : l’épaisseur intima + média
1.1 Définition
Le risque cardiovasculaire, dominé par les accidents coronariens et cérébraux, peut être évalué par la prise en compte des facteurs de risque démontrés par les études longitudinales de cohortes (âge, sexe, diabète, tabagisme, hypertension artérielle, hypercholestérolémie, mais aussi obésité, hypertrophie ventriculaire gauche…), selon un modèle adapté à la population étudiée. Cependant, lorsqu’il s’agit de prendre la décision thérapeutique appropriée à un individu, en prévention primaire notamment, les modèles disponibles restent insuffisamment discriminants. D’autre part, les études prospectives d’intervention, évaluant le bénéfice d’une approche thérapeutique sur le risque cardiovasculaire, peuvent gagner à utiliser des marqueurs objectifs et quantitatifs pour être en mesure, sur des échantillons de taille limitée, et sur des durées restreintes, de démontrer un bénéfice.
C’est dans cette perspective qu’a été proposée, et largement utilisée depuis près de deux décennies, la mesure de l’épaisseur de la paroi artérielle(23). Il importe de mentionner d’emblée :
– Que cette mesure porte, en pratique et pour des raisons physiques et techniques précisées ci-dessous, sur l’ensemble intima + média.
– Qu’il importe de bien distinguer les plaques d’athérome de l’épaississement de l’ensemble intima + média. Ce dernier résulte en fait d’une forme de vieillissement multifactoriel de la paroi vasculaire, et peut exister en dehors de la présence de plaques (et inversement). De fait, la mise en évidence de plaques asymptomatiques lors d’un examen échographique a une valeur prédictive de risque cardiovasculaire supérieure à celle de l’augmentation d’épaisseur intima + média, mais se montre, évidemment, moins sensible.
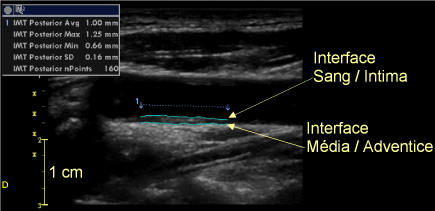
La paroi artérielle apparaît, sur les images échographiques de haute résolution, sous la forme de trois liserés distincts : un liseré interne, de tonalité grise (échogénicité moyenne), un liseré intermédiaire, anéchogène ou très hypo-échogène, et un liseré externe, hyper-échogène. Ces liserés ne correspondent pas, respectivement, à l’intima, la média, et l’adventice, car l’échographie ne montre pas les structures histologiques elles-mêmes mais les interfaces qui les séparent. Ainsi, l’intima forme deux interfaces : l’interface sang / intima et l’interface intima / média. Cependant, seule la première est discernable sur l’image échographique, car la résolution spatiale axiale de l’échographe (y comprise avec les sondes de haute fréquence et très haute résolution) reste très supérieure à l’épaisseur de l’intima, qui atteint tout au plus quelques micromètres. En outre, l’interface intima / média est peu réfléchissante, et la média elle-même est fort peu échogène. De ce fait, l’écho généré par l’interface sang / intima empiète largement sur l’interface intima / média, qui se trouve masquée. En revanche, l’interface média / adventice est bien marquée (tandis que l’interface adventice / tissus péri-adventiciels est imprécise). Il est donc possible de mesurer la distance séparant les deux seules interfaces clairement et précisément discernables : l’interface sang / intima, et l’interface média / adventice. Cette mesure englobe ainsi ce qu’il est d’usage d’appeler l’ensemble « intima + média » (EIM), et cette épaisseur (intima + media thickness : IMT, en anglais) est considérée en pratique comme représentant l’épaisseur de la paroi artérielle.
De plus, la mesure n’est raisonnablement possible que sur le versant de paroi vasculaire le plus éloigné de la sonde (« paroi distale »). Sur le versant plus superficiel, en effet, l’écho de l’interface tissus péri-adventiciels / média empiète de façon variable sur la média, de sorte que la détermination de l’EIM est imprécise.
Si cette épaisseur peut être mesurée sur la plupart des vaisseaux de large et moyen calibre (pour autant que l’on dispose d’une sonde de très haute résolution), les meilleures conditions de précision et de reproductibilité ont été démontrées sur la carotide commune, à distance de la bifurcation.
Plusieurs consensus récents ont déterminé les règles et conditions de mesure de l’EIM, et évoqué son utilisation (encore discutée) dans l’évaluation du risque cardiovasculaire individuel.
1.2 Conditions de mesure
La détermination de l’EIM manuellement à l’aide des verniers de mesure disponibles sur l’échographe n’offre pas les garanties de précision et d’objectivité nécessaires. Le recours à un système automatique et objectif s’impose donc. Il peut s’agir d’un système fondé sur l’échographie en mode M ou en mode bidimensionnel.
– La mesure sur le mode M offre une très haute résolution temporelle, mais n’est offerte que par quelques dispositifs spécialisés. En outre, elle se montre en pratique très délicate, car la mesure se fait sur une unique ligne de tir, et le moindre mouvement ou déplacement intempestif de la sonde peut la dégrader considérablement. Un système spécial de maintien de la sonde est donc indispensable.
– La mesure sur l’image bidimensionnelle est donc beaucoup plus répandue, soit à l’aide d’une station de travail externe, recevant le signal vidéo de l’échographe ou les images au format DICOM, soit, le plus souvent désormais, à l’aide d’un logiciel intégré à l’échographe. La mesure se fait alors dans une zone (généralement rectangulaire) déterminée par l’utilisateur, et dans laquelle le logiciel identifie automatiquement les interfaces et effectue la mesure sur un grand nombre de lignes de tir pour en effectuer ensuite la moyenne, réduisant ainsi l’erreur aléatoire et offrant une résolution de quelques centièmes de mm(fig. 47).
Figure 47: Mesure automatique de l’épaisseur intima + média. Les deux lignes bleues sont tracés automatiquement par le logiciel dans la zone d’intérêt délimitée par l’opérateur. Avg = moyenne ; SD = écart-type. La mesure a ici été effectuée sur 106 points et donne un résultat de 1±0,16 mm sur cette artère carotide commune.
La précision et la reproductibilité de la mesure d’épaisseur de l’EIM imposent en outre le respect de plusieurs conditions :
– L’utilisation d’un échographe de très haute résolution, avec sonde linéaire de haute fréquence (supérieure à 7 MHz, de préférence à 10 ou 12 MHz).
– Une incidence échographique parfaitement perpendiculaire à la paroi artérielle, afin de bénéficier pleinement de la résolution axiale.
– Une mesure en diastole (soit par asservissement du gel d’image sur l’ECG, soit, plus simplement, en utilisant la mémoire cyclique de l’appareil).
– Le recours à des repères topographiques permettant de déterminer de façon précise et reproductible la zone de mesure et l’incidence.
– La mesure simultanée du diamètre luminal systolique et diastolique, afin de pouvoir prendre en compte, notamment, l’effet des variations de pression artérielle lors des études longitudinales. En outre, cette mesure permet de calculer l’aire d’EIM (EIMa =p (Dd/2 + EIM)2–p (Dd/2)2(avecDd= diamètre luminal en diastole), variable mieux représentative de la situation de l’individu à l’égard du risque cardiovasculaire car moins affectée par les variations tensionnelles et vasomotrices.
1.3 Résultats
Mesuré dans les conditions évoquées ci-dessus, l’EIM varie selon l’artère, son diamètre, et le site de mesure.
L’IMT est ainsi un peu plus épais sur la carotide commune gauche que sur la droite.
Le versant profond de la paroi de la carotide commune, à distance de la bifurcation, reste le site de référence pour la mesure de l’EIM. Les conditions techniques sont moins favorables sur la bifurcation et la carotide interne, ainsi que sur le versant superficiel de la paroi de ces artères. En outre, il est plus difficile, dans la région de la bifurcation, de distinguer une plaque d’un simple épaississement de l’EIM.
L’EIM normal, sur les artères carotides communes, est de l’ordre de 0,5 mm chez l’adulte jeune. Il est plus épais, à âge égal, chez l’homme que chez la femme. Il augmente d’environ 0,1 mm par décennie.
L’EIM présente aussi de modestes différences ethniques.
Si l’on considère, en outre, que les dispositifs de mesure automatique de l’EIM ne sont pas équivalents, il est clair que chaque utilisateur doit valider ses propres mesures, dans sa population d’exercice, avant d’en tirer quelque conclusion que ce soit.
L’EIM a montré une association significative avec les différents facteurs de risque cardiovasculaire, mais aussi, de façon indépendante, avec le risque cardiovasculaire lui-même, particulièrement en ce qui concerne les décès d’origine coronarienne ou cérébro-vasculaire.
Par ailleurs, l’EIM a été utilisé largement dans des études prospectives évaluant l’effet de divers traitements (hypolipémiants, anti-hypertenseurs…).
L’intérêt et les limites de l’utilisation de l’EIM feront l’objet d’une analyse et d’une discussion dans les chapitres cliniques de cet ouvrage.
Aujourd’hui, l’EIM constitue donc un remarquable outil de recherche épidémiologique et thérapeutique, mais son utilisation pour l’évaluation du risque cardiovasculaire individuel et pour les actions de prévention qui peuvent en découler impose des conditions de mesure et d’interprétation rigoureuses et reste controversée.
2 – Biomécanique : distensibilité et vitesse de l’onde artérielle
Comme l’EIM, mais sans doute avec une moindre inertie, les altérations biomécaniques de la paroi artérielle peuvent précéder de plusieurs années ou décennies la révélation clinique de la maladie vasculaire(24).
2.1 L’onde artérielle
La souplesse de la paroi artérielle joue un rôle essentiel dans la transformation du flux aortique pulsé en un écoulement capillaire continu. Cette transformation est assurée par le dispositif constitué par les valves cardiaque, la résistance circulatoire périphérique, et l’élasticité de la paroi artérielle. A chaque éjection systolique, en effet, la paroi artérielle (en commençant par l’aorte initiale) se laisse distendre et stocke provisoirement une large part du volume d’éjection systolique, car le niveau de la résistance circulatoire périphérique ne permet pas d’écouler un tel volume dans le seul temps que dure la systole. Une large part (plus des deux tiers) du volume sanguin éjecté du ventricule s’écoule donc perpendiculairement au grand axe du vaisseau (composante radiale, ou transversale, de l’écoulement). Le volume sanguin ainsi stocké est restitué, par retour de la paroi artérielle à sa position de repos, dès la fin de l’éjection systolique, donnant lieu à un écoulement axial. Ce phénomène se propage de proche en proche le long de la paroi artérielle jusqu’en périphérie, constituant l’onde artérielle dont la manifestation la plus connue est le pouls. Son mécanisme et son intérêt ont été initialement décrits par Stephen Hales, en 1733, par analogie au réservoir d’air (« Windkessel », en allemand) qui équipait les pompes à bras avec lesquelles on luttait, autrefois, contre les incendies. Dans le modèle proposé par Hales (et affiné depuis), le secteur veineux constitue un réservoir sanguin, le ventricule et son dispositif valvulaire forment une pompe intermittente, les artères représentent un circuit de distribution (tuyaux), et les artérioles constituent une résistance circulatoire variable (l’extrémité réglable de la lance), tandis que l’élasticité de la paroi artérielle, capable de stocker temporairement volume et pression, fonctionne à l’instar de la « cloche à air » permettant de régulariser le débit(25).
Une perte de souplesse de la paroi artérielle a pour conséquence un accroissement marqué de la pression artérielle systolique, puisque le contenant ne peut plus s’adapter au contenu. En outre, l’onde artérielle se propage plus vite, et sans atténuation, vers la périphérie, de sorte que le lit vasculaire distal est soumis à une pression pulsatile anormalement élevée, ce qui accélère son vieillissement, donc sa sclérose, et participe donc au cercle vicieux de l’artériosclérose. De plus, le régime de pression artérielle plus élevée contre lequel doit lutter le ventricule gauche est un facteur de surcharge, donc d’insuffisance cardiaque. Le travail cardiaque, et donc la dépense énergétique du myocarde, est le produit de la pression développée par le débit sanguin créé. Dès lors que le dispositif de « Windkessel » est altéré, le ventricule doit générer des pressions plus élevées pour maintenir un même débit, et sa dépense énergétique s’accroît. L’altération de l’élasticité de la paroi artérielle est donc un événement délétère à de nombreux égards(26,27).
En termes physiques, la souplesse de la paroi artérielle est décrite par son « module d’élasticité »Ede Young, rapport de la force longitudinale par unité de surface (ou contraintes) à l’allongementequ’elle produit :E =s/e. Le module d’élasticité est d’autant plus grand que la paroi artérielle est moins distensible.
L’élasticité de la paroi artérielle peut être mesurée(28):
- soit directement, en un point, en termes de compliance et distensibilité, à partir des variations de diamètre rapportées aux variations de pression ;
- soit indirectement et sur un segment artériel, par la vitesse de propagation de l’onde artérielle.
2.2 Compliance et distensibilité
La compliance volumiqueCvest l’augmentation de volume artérielDVrépondant à une augmentation donnée de pression DP:
Cv=DV /DP
Il est cliniquement pertinent de rapporter les variations systoliques de volume artériel au volume diastolique (« de base ») et on parle alors de coefficient de distensibilité volumiqueDCv:
DCv= (DV/V) /DP
L’augmentation systolique du volume artériel résultant essentiellement d’une augmentation du diamètred, on peut utiliser, en pratique, le coefficient de distensibilité diamétrale DCd:
DCd = (Dd/d) /DP
avecDd = ds– ddoùds=diamètre luminal systolique etdd=diamètre luminal diastolique.
Le coefficient de distensibilité diamétrale est donc la variable communément mesurée en pratique clinique. Au prix de quelques approximations et simplifications, on peut déduire le module d’élasticité des variations de diamètre artériel rapportées aux variations de pression :
E =DP/(DDd/Dd)
La détermination du coefficient de distensibilité nécessite la mesure de l’accroissement systolique du diamètre de l’artère en un point ou un court segment(29,30):
– soit par échographie en mode M, à l’aide d’un dispositif spécifique (« echo-tracking ») traitant le signal échographique « radio-fréquence », mesure offrant une haute résolution temporelle, mais de maniement très délicat car sujette à d’importants artefacts lors des moindres mouvements intempestifs, et requérant donc le recours à un dispositif micrométrique de maintien de la sonde(fig. 48) ;
– soit par analyse automatique de l’image en mode bidimensionnel, par un logiciel dédié (le plus souvent sur une station de travail traitant le signal vidéo ou DICOM), et procédant, comme pour l’EIM, à une reconnaissance automatique de la paroi et à la mesure du diamètre luminal et de ses variations sur un court segment artériel, délimité par l’utilisateur. Cette technique offre une résolution temporelle moindre (limitée par la cadence d’imagerie, voire par le signal vidéo) et nécessite un préréglage adapté de l’appareil) mais son utilisation est plus facile, et elle peut être utilisée sur tout appareil d’échographie offrant une résolution spatiale convenable.
Il reste à déterminer la variation systolique de pressionDP, c’est-à-dire la différence en pression artérielle systoliquePset pression artérielle diastoliquePd, soit (Ps–Pd), communément appelée « Pression Pulsatile ». La mesure est généralement réalisée sur l’artère brachiale, à l’aide d’un système oscillométrique automatique (moniteur de pression), dès lors que l’on peut considérer que la pression artérielle n’est pas significativement différente entre l’artère brachiale et l’artère qui fait l’objet de la mesure de distensibilité (carotide commune, fémorale…). Cette approximation est plus discutable si l’on souhaite examiner une artère distale, de petit calibre, mais la mesure des variations de diamètre est aussi moins précise à ce niveau, de sorte que de tels sites de mesure doivent êtrea prioriévités.
Figure 48: Mesure de distensibilité locale de l’artère brachiale à l’aide d’un système dédié, en « echo-tracking », sur une ligne de tir échographique en mode M. Le logiciel suit les déplacements de la paroi artérielle, et détermine la courbe des variations du diamètre artériel au cours du cycle cardiaque.
2.3 Vitesse de propagation de l’onde artérielle
L’onde artérielle générée par l’éjection systolique se propage le long de l’aorte, puis sur l’ensemble des artères de conduit et de distribution, à une vitesse qui dépend de l’élasticité de la paroi artérielle : sa propagation s’accélère ainsi lorsque la paroi artérielle perd sa souplesse normale.
La vitesse de propagation de l’onde artérielle ou « onde de pouls »,PWV(Pulse Wave Velocity) est égale à la distanceLrapportée au tempsDtmis à la parcourir :
PWV = L /Dt
L’équation deMoens-Kortewegpermet ensuite de déduire le module d’élasticité de la paroi :
PWV= (Eh/2Rr)½
avech =épaisseur de la paroi,R =rayon de l’artère, etr= densité.
Bramwell et Hillen ont dérivé une équation reliant la vitesse de l’onde artérielle au coefficient de distensibilité :
PWV = (1 /rDCd)½
avecr=densité (en kg.m-3).
La mesure de la vitesse de propagation de l’onde artérielle peut être réalisée très simplement en observant le passage de cette onde en deux points séparés d’une distanceLle long d’un segment artériel (par exemple : aorte ascendante – artère fémorale commune, ou artère subclavière – artère brachiale, ou artère fémorale commune – artère tibiale postérieure)(31).
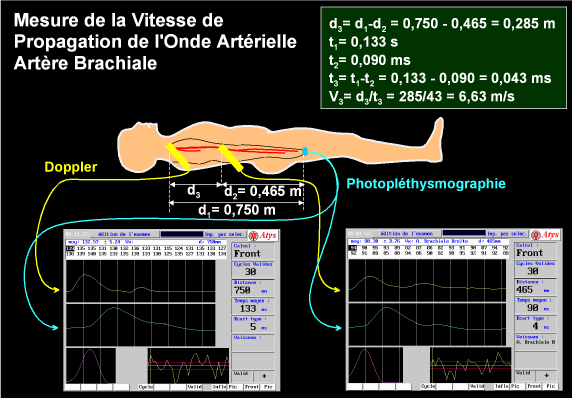
L’onde artérielle peut être, pour cela, détectée par un capteur de pression ou une sonde Doppler ou pléthysmographique. Il est aussi possible de prendre pour référence temporelle l’ECG et effectuer la mesure du délai QRS – onde artérielle dans un premier temps sur le site proximal, puis sur le site distal. Une analyse du signal (généralement une corrélation effectuée sur la phase ascendante du tracé) permet ensuite de déterminer le délai moyen d’arrivée de l’onde artériel aux deux sites d’enregistrement(fig. 49). La distance est mesurée simplement en suivant sur la peau le trajet du segment artériel avec un mètre – ruban.
Des systèmes dédiés sont disponibles pour effectuer cette mesure de façon automatique et totalement non vulnérante.
Figure 49: Mesure de la vitesse de propagation de l’onde artérielle au membre supérieur, à partir du signal Doppler obtenu successivement sur l’artère subclavière et l’artère brachiale au coude, et du signal photopléthysmographique recueillie sur l’index. Le calcul du délai repose sur l’intercorrélation de ces signaux.
2.4 Résultats
Distensibilité ou vitesse de propagation de l’onde artérielle permettent donc de connaître les caractéristiques biomécaniques des artères et de détecter, par exemple, la perte de souplesse résultant du vieillissement, de l’hypertension artérielle chronique, du diabète ou de l’insuffisance rénale chronique…
La vitesse de l’onde artérielle est normalement de l’ordre de 4 m s-1sur l’aorte, proche de 6 m s-1aux membres supérieurs, et de 10 m s-1aux membres inférieurs. D’une façon globale, elle s’accroît lorsque l’on s’éloigne du cœur, en raison des changements de constitution histologique de la paroi artérielle, comportant un large contingent de fibres élastiques sur les larges artères proximales (dites « élastiques »), mais dotée d’une média plus épaisse, riche en fibres musculaires, sur les artère plus distales (dites « musculaires »). Pour la même raison, la pression systolique est plus élevée sur l’artère tibiale postérieure (chez un sujet sain allongé à l’horizontale) que sur l’artère brachiale, car cette dernière, « élastique », présente un module d’élasticité moindre que l’artère tibiale postérieure : l’onde artérielle parvenant à ce niveau détermine une moindre augmentation de diamètre, et, en revanche, une plus grande augmentation systolique de pression.
Selon les objectifs cliniques ou de recherche, il est possible de recourir soit à la mesure de distensibilité, soit à la mesure de vitesse de propagation de l’onde artérielle, en gardant à l’esprit le fait que la mesure de distensibilité est locale, alors que la vitesse de l’onde artérielle fait l’objet d’une mesure segmentaire. Sur certaines artères, comme les carotides, seule la distensibilité peut être directement mesurée. Sur les membres, la vitesse de l’onde artérielle est de détermination facile et donne probablement une information plus globale sur l’état de la paroi vasculaire.
L’intérêt physiopathologique et clinique de la mesure de distensibilité artérielle sera analysé et discuté dans les chapitres cliniques de cet ouvrage.
La distensibilité de la paroi artérielle diminue avec l’âge, l’hypertension artérielle (cette altération pouvant être ou non réversible selon la durée d’évolution, qui entraîne à terme un remodelage histologique de la paroi), le diabète, l’insuffisance rénale sévère, les dyslipidémies, le tabagisme…
3 Fonction : endothélium et vasomotricité
3.1 Endothélium et vasomotricité
L’endothélium vasculaire constitue une interface dynamique entre le sang circulant et la paroi vasculaire, et joue un rôle essentiel non seulement dans l’étanchéité du secteur circulant et dans l’hémostase, mais aussi dans la réception et la transmission de messages mécaniques et humoraux, et l’émission, à destination de la cellule musculaire lisse sous-jacente, des messages vasomoteurs, représentés en particulier par des facteurs vasorelaxants comme lesEDRF(Endothelium Derived Relaxing Factors), dont les principal est constitué par l’oxyde nitrique (NO), mais qui comporte aussi desEDHF(Endothelium Derived Hyperpolarizing Factors) et des prostaglandines (notamment la prostacycline), et des facteurs vasoconstricteurs comme l’endothélineet d’autres prostaglandines.
L’écoulement sanguin au contact de l’endothélium produit des forces de cisaillement, proportionnelles à la vitesse circulatoire, activant des récepteurs de membranes et déclenchant une augmentation de la production et de la libération de NO. Celui-ci diffuse rapidement vers la cellule musculaire lisse vasculaire où il interfère avec le métabolisme du GMPc pour provoquer une relaxation, d’où une augmentation du diamètre vasculaire.
Dès lors que le débit dans un vaisseau augmente (par exemple, dans une artère, en cas de vasorelaxation artériolaire d’aval, telle qu’elle résulte d’une augmentation d’activité métabolique), ce mécanisme induit une vasorelaxation, par laquelle le diamètre du vaisseau augmente pour « s’adapter » à son débit. C’est notamment ce qui se passe constamment en réponse à l’exercice musculaire : le diamètre des artères de conduit et de distribution augmente en proportion de l’hyperémie consécutive à l’activité musculaire.
3.2 Le test d’hyperémie post-ischémique
Une épreuve dynamique simple, proposée par Celemajer(32,33), permet d’objectiver et quantifier cette fonction endothéliale vasomotrice : il suffit d’observer et mesurer en échographie le diamètre de l’artère brachiale avant, pendant, et après le gonflement d’un garrot pneumatique, installé à l’avant-bras, au dessus de la pression artérielle systémique, pour une durée (usuelle) de 4 minutes(34,35).
L’hyperémie post-ischémique qui apparaît à la levée du garrot entraîne une augmentation de débit de l’artère brachiale, donc une production accrue de NO dans sa paroi, aboutissant à une vasorelaxation : le diamètre de l’artère brachiale, qui diminue significativement pendant la phase d’ischémie (où le débit de l’artère brachiale est réduit) augmente significativement dans la minute qui suit la levée du garrot. Chez un sujet adulte jeune en bonne santé, cette dilatation est de l’ordre de 10%.
L’interprétation de ce test nécessite cependant de s’assurer de la capacité de vasorelaxation du muscle lisse vasculaire indépendamment de l’endothélium. Si, en effet, pour une raison mécanique (sclérose prononcée, par exemple) ou fonctionnelle (altération de la fibre musculaire elle-même), l’artère était incapable de présenter une vasorelaxation significative, le rôle de l’endothélium ne pourrait être démontré. Une « contre-épreuve » est donc réalisée simplement en mesurant la vasorelaxation de l’artère brachiale en réponse à l’administration (généralement sublinguale) d’un dérivé nitré. Le test d’hyperémie post-ischémique n’est exploitable que si la réponse au dérivé nitré est positive.
3.3 Résultats
De très nombreuses pathologies s’accompagnent d’une dysfonction de l’endothélium qui peut être mise en évidence par ce test(17,35,36,37,38). Ses résultats sont altérés dans le contexte des principaux facteurs de risque cardiovasculaire, et la dysfonction endothéliale est considérée comme jouant alors un rôle crucial dans la physiopathologie des maladies cardiovasculaire. L’obésité, le tabagisme, le syndrome métabolique… s’accompagnent d’une telle dysfonction.
Le test de vasorelaxation post-ischémique est donc très largement utilisé pour mettre en évidence une altération de la fonction endothéliale vasomotrice, mais aussi son éventuelle amélioration sous l’effet d’une prise en charge thérapeutique.